El Mal de Chagas es una de las enfermedades transmisibles más importantes en Latinoamérica, junto con las infecciones respiratorias agudas, diarreas infantiles y el Síndrome de inmunodeficiencia adquirida (SIDA). En Argentina, y según el informe del año 2010 de la Organización Mundial de la Salud, es considerada una enfermedad endémica, afectando al 7,2% de la población total del país.
Una de las manifestaciones más devastadoras de esta enfermedad es la Cardiopatía chagásica crónica, que la padecen aproximadamente el 30% de las personas infectadas. A pesar del número importante de investigaciones realizadas, se desconoce en forma indubitable cuáles son los factores que llevan a un paciente crónico asintomático a padecer alteraciones cardiacas, aunque la persistencia del parásito en reservorios tisulares (tejido cardiaco, muscular, adiposo), y la respuesta inmune que genera serían las principales causas que llevan a cuadros patológicos. Basado en estos conocimientos, reducir el crecimiento y evitar la supervivencia del parásito, así como modular la respuesta inmunológica del paciente podría ser una alternativa terapéutica alentadora en el control de esta enfermedad.
Nuestro laboratorio esta principalmente interesado en el estudio de la respuesta inmunológica desarrollada en el individuo durante la fase crónica de la Enfermedad de Chagas. Nuestro objetivo es contribuir a dilucidar los mecanismos de patogenia que llevan a un paciente crónico asintomático a padecer alteraciones cardiacas, así como también identificar posibles nuevos blancos con proyección a la prevención y/o tratamiento de esta enfermedad.
Integrantes del grupo

Dra. Mariana Potenza
Investigadora Adjunta CONICET
marian.potenza@gmail.com
potenza@dna.uba.ar

Dra. Fátima Ferragut
Becaria Post-doctoral CONICET
Director: Morten Nielsen (IIB-UNSAM), Co-Directora: Karina Gómez
fati_ferra@hotmail.com

Lic. Micaela Ossowski
Becaria Doctoral CONICET
Directora: Karina Gómez, Co-Directora: Karina Mariño (IBYME)
micaelaossowski@hotmail.com

Lic. Jessica Jenireth Rodríguez Durán
Becaria Doctoral CONICET
Directora: Mariana Potenza
jessrodriguez@dna.uba.ar

Bioq. Karen Magalí Cruz
Becaria Doctoral CONICET
Directora: Karina Gómez
karenmagalicruz@outlook.com

Lic. Juan Pablo Gallardo
Becario Doctoral ANCyT
Directora: Mariana Potenza, Co-Directora: Karina Gómez
jpgallardo2013@outlook.com
Publicaciones (2016-2023)
Activation-induced marker assays for identification of Trypanosoma cruzi-specific CD4 or CD8 T cells in chronic Chagas disease patients
Ferragut F, Cruz KM, Gallardo JP,Fernández M,Hernández Vasquez Y, Gómez KA
Immunology. 2023 Jun;169(2):185-203. doi: 10.1111/imm.13622.
Expression of Inhibitory Receptors TIGIT, TIM-3, and LAG-3 on CD4+ T Cells from Patients with Different Clinical Forms of Chronic Chagas Disease.
Ferragut F, Alcaraz PB, Beati P, Girard MC, Ossowski MS, Chadi R, Fernández M, Hernández-Vásquez Y, Acevedo GR, Gómez KA.
J Immunol. 2023 Mar 1;210(5):568-579. doi: 10.4049/jimmunol.2200436.
The Kinetoplastid-Specific Protein TcCAL1 Plays Different Roles During In Vitro Differentiation and Host-Cell Invasion in Trypanosoma cruzi.
Rodríguez-Durán J, Gallardo JP, Alba Soto CD, Gómez KA, Potenza M.
Front Cell Infect Microbiol. 2022 Jun 30;12:901880. doi: 10.3389/fcimb.2022.901880.
Galectins in Chagas Disease: A Missing Link Between Trypanosoma cruzi Infection, Inflammation, and Tissue Damage.
Poncini CV, Benatar AF, Gomez KA, Rabinovich GA.
Front Microbiol. 2022 Jan 3;12:794765. doi: 10.3389/fmicb.2021.794765.
In vitro differentiation of Trypanosoma cruzi epimastigotes into metacyclic trypomastigotes using a biphasic medium
Rodríguez Durán J, Muñoz-Calderón A, Gómez KA, Potenza M.
STAR Protocols. 2021. doi: 10.1016/j.xpro.2021.100703
Trypanosoma cruzi induces regulatory B-cell alterations in patients with chronic Chagas disease.
Girard MC, Ossowski MS, Muñoz-Calderón A, Fernández M, Hernández-Vásquez Y, Chadi R, Gómez KA.
Frontiers in Celullar and Infection Microbiology, Front. Cell. Infect. Microbiol. 2021. doi: 10.3389/fcimb.2021.723549
IgE antibodies against Trypanosoma cruzi arginine kinase in patients with chronic Chagas disease.
Valera-Vera EA, Concepción JL, Cáceres AJ, Acevedo GR, Fernández M, Hernández Y, Digirolamo FA, Duschak VG, Soprano LL, Pereira CA, Miranda MR, Gómez KA.
Mol Immunol. 2021. doi: 10.1016/j.molimm.2021.06.024
T cell specificity: a great challenge in Chagas disease.
Ferragut F, Acevedo GR, Gómez KA.
Frontiers in Immunology, 2021. doi: 10.3389/fimmu.2021.674078
Ex vivo characterization of Breg cells in patients with chronic Chagas disease.
Girard MC, Acevedo GR, Ossowski MS, Fernández M, Hernández Y, Chadi R, Gómez KA.
Sci Rep. 2021. doi: 10.1038/s41598-021-84765-x
Recombinant antibody against Trypanosoma cruzi from patients with chronic Chagas heart disease recognizes mammalian nervous system.
Niborskia LL, Potenza M, Chirivi RGS, Simonetti L, Ossowski MS, Grippo V, May M, Staquicinie DI, Parodi-Talice A, Robello C, Comini MA, Alonso GD, Raats JMH, Gómez KA.
EBioMedicine. 2021. doi: 10.1016/j.ebiom.2020.103206
In Silico Guided Discovery of Novel Class I and II Trypanosoma cruzi Epitopes Recognized by T Cells from Chagas’ Disease Patients
Acevedo GR, Juiz NA, Ziblat A, Pérez Perri L, Girard MC, Ossowski MS, Fernández M, Hernández Y, Chadi R, Wittig M, Franke A, Nielsen M, Gómez KA.
J Immunol. 2020 Mar 15;204(6):1571-1581. doi: 10.4049/jimmunol.
T. cruzi infection. Methods in Molecular Biology Book.
Editors: Buscaglia CA and Gomez KA. Publisher: Humana Press; 1st ed. 2019 edition (April 16, 2019); ISBN-10: 1493991477; ISBN-13: 978-1493991471
Generation of T. cruzi-Specific Primary CD4+ T Cell Lines from Peripheral Blood Mononuclear Cells Isolated from Chagas Disease Patients.
Acevedo GR, Alcaráz PB, Pinilla C, Gómez KA.
Methods Mol Biol. 2019;1955:315-337. doi: 10.1007/978-1-4939-9148-8_24
Production of Recombinant Trypanosoma cruzi Antigens in Leishmania tarentolae.
Ferrer MJ, Wehrendt DP, Bonilla M, Comini M, Tellez MT, Potenza M.
T. cruzi Infection – Methods and Protocols, 2019. doi: 10.1007/978-1-4939-9148-8_8
Altered frequency of CD24highCD38high transitional B cells in patients with cardiac involvement of chronic Chagas disease
Girard MC, Acevedo GR, Ossowski MS, Alcaráz PB, Fernández M, Hernández Y, Chadi R, Gómez KA
BioRxiv 2019. doi: https://doi.org/10.1101/684589.
CD4+ T cells from chronic Chagas disease patients with different degrees of cardiac compromise exhibit distinct expression patterns of inhibitory receptors TIGIT, Tim-3 and Lag-3.
Alcaraz PB, Girard MC, Beati P, Chadi R, Fernandez M, Hernandez Y, Gómez KA, Acevedo GR.
BioRxiv 2019. doi: https://doi.org/10.1101/694729
Generation of T. cruzi-Specific Primary CD4+ T Cell Lines from Peripheral Blood Mononuclear Cells Isolated from Chagas Disease Patients.
Acevedo GR, Alcaráz PB, Pinilla C, Gómez KA. (2019)
Methods Mol Biol. 2019;1955:315-337.
The Unsolved Jigsaw Puzzle of the Immune Response in Chagas Disease
Acevedo GR, Girard MC, Gómez KA. (2018)
Front. Immunol. August 2018 https://doi.org/10.3389/fimmu.2018.01929
A Panoramic View of the Immune Response to Trypanosoma cruzi Infection. In Chagas Disease: A clinical approach
Acevedo GR, Girard MC, Gómez KA. (2018)
Editors Jaime Marcelo Altcheh, Hector Freilij, Publisher Springer International Publishing, Switzerland, ISBN 978-3-030-00053-0.
Evaluation of the immune response against Trypanosoma cruzi cytosolic tryparedoxin peroxidase in human natural infection
Girard MC, Acevedo GR, López L, Ossowski MS, Piñeyro MD, Grosso JP, Fernandez M, Hernández Vasquez Y, Robello C, Gómez KA. (2018)
Immunology. 2018 Jul 4. doi: 10.1111/imm.12979.
Transcriptome-wide analysis of the Trypanosoma cruzi proliferative cycle identifies the periodically expressed mRNAs and their multiple levels of control.
Chávez S, Eastman G, Smircich P, Becco LL, Oliveira-Rizzo C, Fort R, Potenza M, Garat B, Sotelo-Silveira JR, Duhagon MA. (2017)
PLoS One. 2017 Nov 28;12(11):e0188441
Methodological approach to the ex vivo expansion and detection of T. cruzi-specific T cells from chronic Chagas disease patients
Acevedo GR, Longhi SA, Bunying A, Sabri N, Atienza A, Zago MP, Santos R, Judkowski VA, Pinilla C, Gómez KA. (2017)
PLoS One. 2017 May 26;12(5):e0178380.
Characterization of TcCYC6 from Trypanosoma cruzi, a gene with homology to mitotic cyclins.
Di Renzo MA, Laverrière M, Schenkman S, Wehrendt DP, Tellez-Iñón MT, Potenza M. (2016)
Parasitol Int. 2016 Jun;65(3):196-204.
Lineas de Investigación
Identificación de epitopes de linfocitos T contra T. cruzi en pacientes con Enfermedad de Chagas crónica (Integrante involucrado: Dra. Fátima Ferragut).
La caracterización de los péptidos presentados a las células T CD4+ y CD8+ en el contexto de las moléculas del complejo mayor de histocompatibilidad (CMH), es fundamental tanto en la comprensión de las bases biológicas y moleculares de la enfermedad, como en el origen de nuevas y eficaces inmunoterapias. Hasta el momento, únicamente un poco más de 100 epitopes de T. cruzi se han descripto (los cuales sólo pertenecen a 62 proteínas del vasto proteoma del parásito, comprendido por 22.570 genes codificantes de proteínas), siendo la mayoría restringidos a un único haplotipo de HLA tipo I. En nuestro laboratorio, aplicando la estrategia de predicción bioinformática de epitopes T basada en redes neuronales artificiales, hemos identificado 7 péptidos que contienen epitopes activadores de secreción de IFN-γ en muestras de células mononucleares (CMN) de pacientes con enfermedad de Chagas crónica. Como continuación de este trabajo, la presente línea de investigación estudia el repertorio de los péptidos (inmunopeptidoma) de T. cruzi que son procesados naturalmente y presentados en el contexto del CMH, mediante la combinación de espectrometría de masas y análisis bioinformático. Esta aproximación nos ha permitido identificar péptidos provenientes de antígenos de T. cruzi tanto intracelulares como de superficie. Los mismos serán validados mediante diferentes estrategias que posibilitarán caracterizar la respuesta inmune que dichos complejos inducen al ser mostrados a los linfocitos T de los pacientes con diferente estadio clínico de la Enfermedad de Chagas.
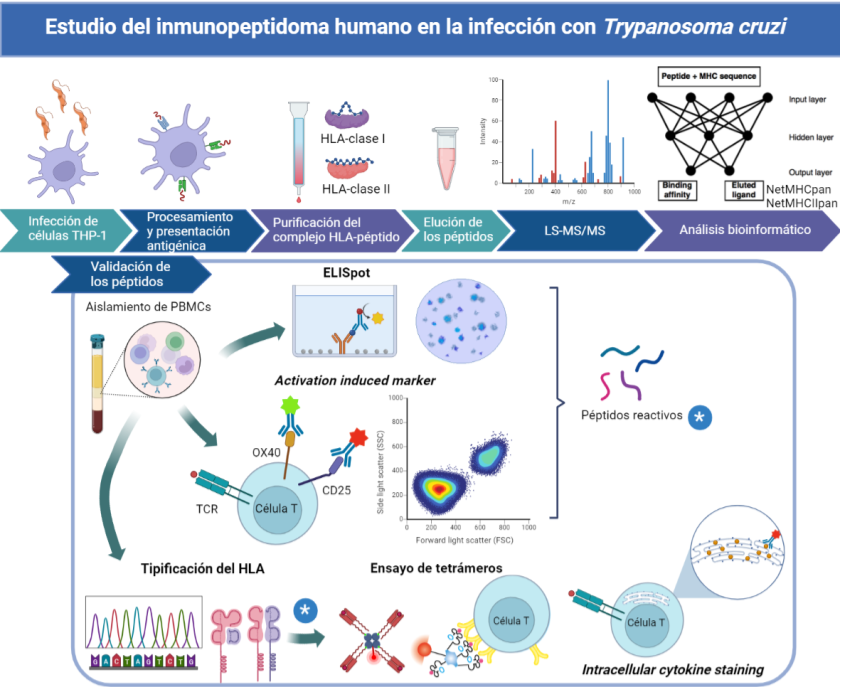
Abordaje experimental del estudio del inmunopeptidoma humano en el contexto de la infección con T. cruzi.
Rol de los componentes del sistema inmune en la respuesta ant-T. cruzi en el contexto de la Enfermedad de Chagas crónica (Integrantes involucrados: Bioq. Karen M. Cruz).
A pesar de años de investigación y discusión, se desconoce la razón por la cual mientras que algunos individuos desarrollan sintomatología, otros no lo hacen. La evidencia acumulada señala que la respuesta inmunitaria del paciente juega un rol central en ese proceso. Nuestro objetivo es estudiar en forma integral los eventos inmunológicos que ocurren en las células del sistema inmune de los individuos en respuesta a los antígenos de T. cruzi durante la fase crónica de la enfermedad de Chagas. Para ello, proponemos analizar el perfil de expresión génica de las células mononucleares provenientes de pacientes con enfermedad de Chagas crónica, con y sin sintomatología demostrable, frente a la estimulación con antígenos de T. cruzi, e integrar esta información con otros datos de caracterización fenotípica y funcional de las células y los datos clínicos de los pacientes. Este proyecto busca incorporar un nuevo integrante para la realización de una tesis doctoral con beca ANCyT otorgada.
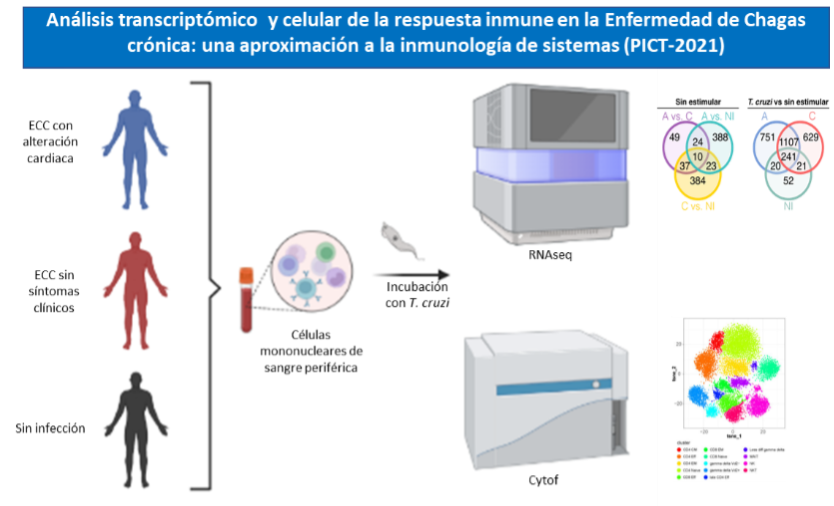
Abordaje experimental
Asimismo, es nuestro interés estudiar el rol de los mecanismos de regulación desarrollados por el sistema inmune, en particular el de los linfocitos CD4+ LAG-3+, los cuales se encuentra aumentados en los pacientes sin sintomatología detectable.
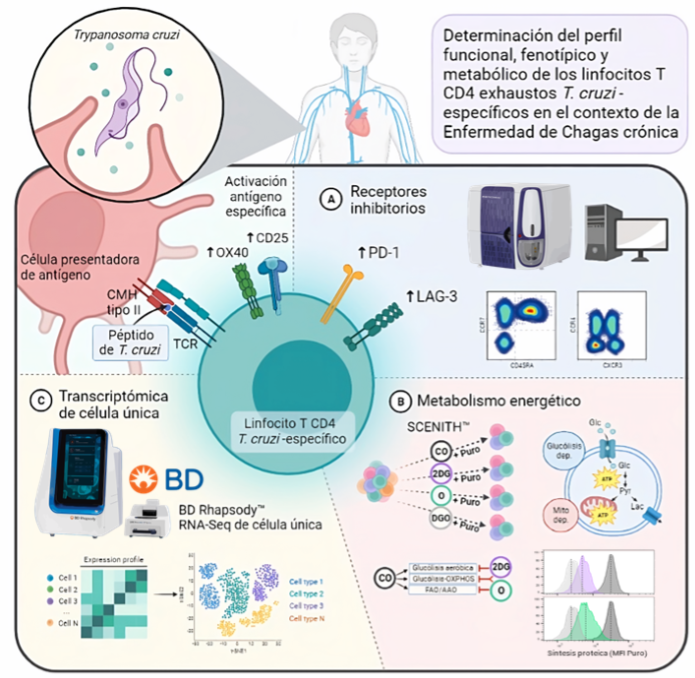
Abordaje experimental
Caracterización funcional de nuevas proteínas identificadas en T. cruzi (Integrantes involucrados: Dra. Mariana Potenza, Lic. Jessica Rodríguez Durán, Dra. Karina Gómez, Lic. Micaela Ossowski, Lic. Juan Pablo Gallardo).
Este proyecto busca incorporar un nuevo integrante para la realización de una tesis doctoral con beca ANCyT otorgada.
Al igual que otras especies, T. cruzi expresa un alto porcentaje de proteínas hipotéticas conservadas, exclusivas de la familia de los tripanosomátidos y cuya función es desconocida. El estudio funcional de estas proteínas permite avanzar en el conocimiento de la biología del parásito, definiendo actividades metabólicas únicas, distintas de las células de mamífero que este parasita. La caracterización de estas vías y sus componentes pueden establecer nuevos blancos terapéuticos potenciales para el tratamiento de esta enfermedad. Actualmente llevamos adelante el estudio funcional de dos proteínas exclusivas de T. cruzi, mediante el uso de herramientas de ingeniería genética y biología celular: 1. Una nueva proteína con dominios de unión a Ca+2 (TcCAL1), evaluando su rol en procesos importantes del ciclo de vida del parásito, como la diferenciación y la invasión a células de mamífero; 2. Una proteína con dominios de quinoproteína alcohol deshidrogenasa (Tc323), estudiando su relevancia en la proliferación y el metabolismo de detoxificación celular del parásito. Además, esta proteína presenta un potencial uso como diagnóstico de enfermedad en la fase crónica.
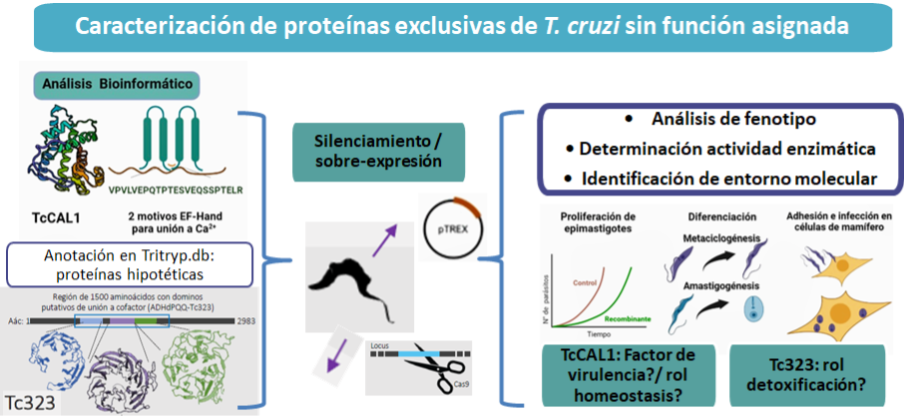
Abordaje experimental y resultados obtenidos en la caracterización funcional de proteínas sin función asignada en T. cruzi (anotadas como hipotéticas en la base de datos de Proyectos Genoma de Tripanosomas)
Expresión de proteínas recombinantes utilizando tripanosomas no patógenos (Integrante involucrado: Dra. Potenza)
Mediante el uso de sistemas comerciales y del diseño y la construcción de líneas transgénicas en nuestro laboratorio, utilizamos cultivos de especies de tripanosomas no patógenos (Leishmania tarentolae, Crithidia fasciculata) como biorreactores para la expresión de antígenos y proteínas que requieran modificaciones post-traduccionales complejas para su actividad.
Posiciones ofrecidas
Actualmente tenemos las siguientes búsquedas activas:


En nuestro laboratorio siempre está ávido de incorporar nuevos integrantes con muchas ganas de formarse en este interesante mundo de la investigación científica.
Si te gustan nuestras líneas de trabajo, y queres formar parte, envía tu CV a drkagomez@gmail.com.
Financiamiento
2023-2026. ANCyT PICT-2021-GRF-TII- 00123
“Caracterización funcional de una nueva proteína con dominios de unión a calcio de Trypanosoma cruzi: estudio de su rol en la diferenciación e invasión celular”
Investigadora Principal: Mariana Potenza
2021-2024. ANCyT PICT-2021-0662
“Análisis transcriptómico de la respuesta inmune en la Enfermedad de Chagas crónica: una aproximación a la inmunología de sistemas.”
Investigador Principal: Karina A. Gómez
2020-2023. ANCyT-PICT-2020-1640
“Caracterización funcional de una nueva proteína de Trypanosoma cruzi con alto potencial diagnóstico de la enfermedad de Chagas.”
Investigador Principal: Karina A. Gómez
2020-2023. ANCyT PICT-2020-1299
“Estudio del inmunopeptidoma humano en la infección con Trypanosoma cruzi: un nuevo enfoque en la búsqueda de antígenos vacunales.”
Investigador Principal: Fátima Ferragut
2015-2021. PIP-CONICET 112-2015010-0547
“Búsqueda de potenciales antígenos vacunales para la Enfermedad de Chagas crónica a partir del estudio de la especificidad de células T humanas y el uso de herramientas de inmunobioinformática.”
Investigador Principal: Karina A. Gómez
2016-2020. ANPCyT-PICT- 201-1028
“A- Caracterización funcional de TcCALI, una proteína hipotética de unión a calcio expresada en Trypanosoma cruzi. B- Construcción de un sistema inducible de expresión de proteínas recombinantes en Crithidia fasciculata.”
Investigador Principal: Mariana Potenza
2016-2017. Fundación Roemmers
“Identificación por predicción bioinformática y validación de epitopes para el estudio de la respuesta inmune celular en pacientes con enfermedad de Chagas crónica.”
Investigador Principal: Gonzalo R. Acevedo
2014-2017. ANPCyT-PICT-2014-1026
“Identificación de epitopes de linfocitos T contra Trypanosoma cruzi en pacientes con Enfermedad de Chagas crónica: bases para el desarrollo de una vacuna.”
Investigador Principal: Karina A. Gómez
2015-2017. NIH1R21AI109439-01A1
“T cell driven antigen discovery for vaccine candidates for human Chagas disease.”
Investigador Principal: Clemencia Pinilla
Ex integrantes
Dra. Leticia L. Niborski
Dr. Alejandro F. Benatar
CPA – IBYME (área citometría de flujo)
Vet. Laura Tasso
Instituto Nacional de Parasitología “Dr. Mario Fatala Chaben”
Dr. Gonzalo R. Acevedo
Division of Experimental Medicine
University of California, San Francisco at Zuckerberg San Francisco General
Lic. Lucas Perez Perri
Lic. Paula Alcaráz
Dra. Magalí Celeste Girard
Colaboraciones
Dr. Morten Nielsen
Investigador Principal CONICET, IIB-UNSAM, Buenos Aires, Argentina.
Associate Professor, Center for biological sequence analysis, Technical University of Denmark.
Dra. Clemencia Pinilla
Investigadora Asociada
Torrey Pines Institute for Molecular Studies (TPIMS), La Florida, USA
Dra. Nicola Ternette
Investigador Principal
Nuffield Department of Medicine, University of Oxford, UK
www.ndm.ox.ac.uk
Dra. Diana Hansen
Investigador Principal
The Walter and Eliza Hall Institute of Medical Research; Australia
www.wehi.edu.au
Dra. Catalina Alba Soto
Investigador Independiente CONICET, IMPAM, Buenos Aires, Argentina
Dr. Carlos Robello
Investigador Principal, Instituto Pasteur de Montevideo, Uruguay
Instituto Pasteur de Montevideo, Uruguay.
Dr. Rafael Argüello
Investigador Principal, Centre national de la recherche scientifique (CNRS), Marsella, Francia
Dr. Marcelo Comini
Investigador Principal, Instituto Pasteur de Montevideo, Uruguay
http://pasteur.uy
Dra. María Paola Zago
Investigador Independiente, Instituto de Patología Experimental, Salta, Argentina
http://ipe.unsa.edu.ar
MD Marisa Fernández y Yolanda Hernández
Instituto Nacional de Parasitología “Dr. Mario Fatala Chabén”, Buenos Aires, Argentina
MD Raúl Chiadi
Hospital General de Agudos “Dr. Ignacio Pirovano”, Buenos Aires, Argentina
Convenios y Actividades de Transferencia
2021-actual: STAN Nº 5651: Producción de proteínas recombinantes en sobrenadante de cultivo utilizando sistemas de expresión eucariotas. Inv. Responsable: Mariana Potenza
2019-actual: STAN Nº 4532, 4533, 4534: Producción de Proteínas recombinantes de T. cruzi. Inv. Responsable: Karina Gómez
2010-2018: Representante técnico del Convenio celebrado entre CONICET y la empresa holandesa Modiquest Research BV, cuyo representante legal es el Dr. Jos Raats (Resolución Nº 2192, del 7 de Agosto de 2009). Inv. Responsable: Karina Gómez
2012-2014: Convenio con la Empresa IAC Internacional, con el objetivo de desarrollar un kit diagnóstico para la Enfermedad de Chagas (Resolución Nº 0311, del 27 de Enero de 2012). Inv. Responsable: Karina Gómez
2021: STAN Nro. 5651: Producción de proteínas recombinantes en sobrenadante de cultivo utilizando sistemas de expresión eucariotas. Inv. Responsable: Mariana Potenza

- Bioquímica, Facultad de Farmacia y Bioquímica, Universidad de Buenos Aires. 1990.
- Farmacéutica, Facultad de Farmacia y Bioquímica, Universidad de Buenos Aires. 1992.
- Doctora, Universidad de Buenos Aires. 1998.
- Investigador Independiente CONICET. 2005 – cont.
- Jefe de Trabajos Prácticos, Depto Química Biológica, Facultad de Farmacia y Bioquímica, UBA. 2012 – cont.
