El objetivo principal de nuestro trabajo es entender cómo son traducidas las señales lumínicas por los fitocromos y los componentes río abajo involucrados.
Las plantas como organismos sésiles han adquirido un desarrollo adaptativo muy sofisticado que les permite ajustar el fenotipo al ambiente en el cual se encuentran. La luz es el estímulo externo que más influye en el desarrollo de las plantas y gatilla un conjunto de respuestas llamada en su conjunto fotomorfogenesis (desetiolación), vital para el establecimiento de la autotrofía de las plantas. En oscuridad la fotomorfogénesis está reprimida. La luz es percibida por diferentes fotorreceptores entre los que se encuentran los fitocromos que perciben la luz roja y roja lejana y los criptocromos que perciben la luz azul. Los fotorreceptores actúan a través de varios mecanismos moleculares como la traslocación al núcleo e interacción con factores de transcripción, la interacción con proteínas involucradas en las vías de degradación, y a través de modificaciones postraduccionales como la fosforilación. Varios fotorreceptores se regulan por fosforilación y son capaces de inducir la fosforilación/defosforilación de otras proteínas. Nuestro objetivo es analizar cómo los fotorreceptores están involucrados directa o indirectamente regulando quinasas y/o fosfatasas y cuál sería la relevancia biológica de dichas modificaciones postraduccionales in vivo. Para ello en el laboratiorio utilizamos la combinación de técnicas moleculares, estudios de proteómica, y análisis de mutantes y sobreexpresantes.
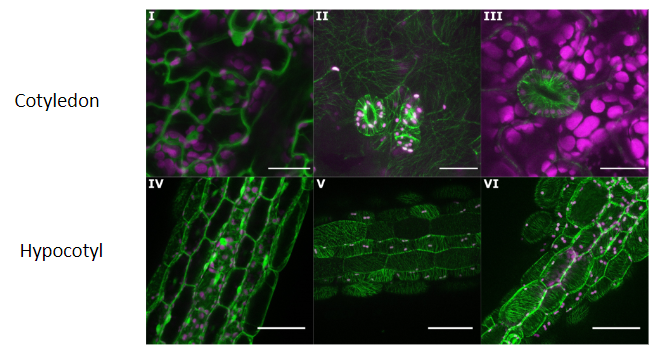
(Arico et al., 2024)
Integrantes del grupo
Lic. Natalia Burachik
Becaria Doctoral
nburachik[at]dna.uba.ar
Dr. Franco Santin
Personal de Apoyo a la Investigación y Desarrollo (CPA)
Publicaciones
Arabidopsis hypocotyl growth in darkness requires the phosphorylation of a microtubule-associated protein.
Denise Soledad Arico, Natalia B. Burachik*, Diego Leonardo Wengier* and Mazzella MA.
Plant J. (2024). https://doi.org/10.1111/tpj.16711
A novel strategy to uncover specific GO terms/phosphorylation pathways in phosphoproteomic data in Arabidopsis thaliana.
Arico DS, Beati P, Wengier DL, Mazzella MA.
BMC Plant Biol. 2021 Dec 14;21(1):592. doi: 10.1186/s12870-021-03377-9. PMID: 34906086; PMCID: PMC8670200.
Neighbour signals perceived by phytochrome B increase thermotolerance in Arabidopsis.
Arico D, Legris M, Castro L, Garcia CF, Laino A, Casal JJ, Mazzella MA.
Plant Cell Environ. 2019 Sep;42(9):2554-2566. doi: 10.1111/pce.13575. PMID: 31069808
A proteome map of a quadruple photoreceptor mutant sustains its severe photosynthetic deficient phenotype.
Fox AR, Barberini ML, Ploschuk EL, Muschietti JP, Mazzella MA.
J Plant Physiol. 2015 ;185:13-23.
Hormonal networks involved in apical hook development in darkness and their response to light.
Mazzella MA, Casal JJ, Muschietti JP, Fox AR. 2014.
Frontiers in plant Sciences, 5, 52 doi:10.3389/fpls.2014.00052.
cry1 and GPA1 signaling genetically interact in hook opening and anthocyanin synthesis in Arabidopsis.
Fox AR, Soto GC, Jones AM, Casal JJ, Muschietti JP, Mazzella MA. 2012.
Plant Mol Biol. Oct;80(3):315-24.
Mutations in two putative phosphorylation motifs in the tomato pollen receptor kinase LePRK2 show antagonistic effects on pollen tube length.
Salem T, Mazzella A, Barberini ML, Wengier D, Motillo V, Parisi G, Muschietti J.
J. .Biol Chem. Feb 11;286(6):4882-91.
STIL, a peculiar molecule from styles, specifically dephosphorylates the pollen receptor kinase LePRK2 and stimulates pollen tube growth in vitro.
Wengier DL, Mazzella MA, Salem TM, McCormick S, Muschietti JP.
BMC Plant Biol. 2010. 222;10:33.
Metabolic responses to red/far red ratios and ontogeny show poor correlation with the growth rate of sunflower stems.
Mazzella MA, Zanor MI, Fernie A, Casal JJ. 2008.
Jorunal of Experimental Botany 59: 2469-2477.
Phytochrome control of the Arabidopsis transcriptome anticipates seedling exposure to light.
Mazzella MA, Arana MV, Staneloni RJ, Perelman S, Rodriguez Batiller MJ, Muschietti J, Cerdán PD, Chen K, Sánchez RA, Zhu T, Chory J, Casal JJ. 2005.
Plant Cell, 17 (9), 2507-2516.
Finding unexpected patterns from microarray data.
Perelman S, Mazzella MA, Muschietti J, Zhu T, Casal JJ. 2003.
Plant Physiology, 133: 1717-1725.
Interactive signalling by phytochrome and cryptochrome generates de-etiolation homeostasis in Arabidopsis thaliana.
Mazzella MA, Casal JJ.
Plant, Cell and Environment 24, 155-161.
Hierarchical Coupling of phytochromes and cryptochromes reconciles stability and light modulation of Arabidopsis development.
Mazzella MA, Cerdan P, Staneloni R, Casal JJ. 2001.
Development, 128, 2291-2299.
Proyectos
Financiamiento
Proyectos de Investigación Plurianuales (PIP). 2020
Investigador responsable compartido con Dr. Nahuel González Schain del IBR
PICT 2018-2021 para grupos formados.
Investigador Responsable.
PICT 2014-2017.
Estudio del fosfoproteoma inducido por luz. Participación de los fotorreceptores y análisis de la función biológica de fosfoproteínas en plantas.
Período: 2014-2017.
Proyectos de Investigación Plurianuales (PIP).
Análisis funcional del perfil de fosfoproteínas inducidos por la luz en plantas.
Período: 2013-2015.
Ex integrantes
Dra. Luciana Castro
Dra. Denise Arico
denise_arico@outlook.com.ar
Lic. Christian Lisi
Tesinista
Dra. Romina Fox
foxromina@gmail.com

- Licenciada en Ciencias Biológicas. Universidad de Buenos Aires. 1995.
- Doctor de la Universidad de Buenos Aires, Área Ciencias Biológicas, Facultad de Ciencias Exactas y Naturales. 2001. Laboratorio del Dr. Jorge Casal, IFEVA UBA
- Postoc en el laboratorio de Jorge Muschietti, INGEBI. 2002.
- Investigador Independiente CONICET. 2015 – Cont.
